Novo método de microscopia eletrônica leva o Prêmio Nobel de Química

O suíço Jacques Dubochet, o alemão Joachim Frank e o escocês Richard Henderson foram laureados pelo desenvolvimento da microscopia crioeletrônica, que revolucionou a bioquímica ao permitir imagens de alta resolução das moléculas biológicas
O Prêmio Nobel da Química de 2017 foi concedido ao suíço Jacques Dubochet, ao alemão Joachim Frank e ao escocês Richard Henderson pelo desenvolvimento de métodos de microscopia que revolucionaram a bioquímica utilizando temperaturas muito baixas.
O anúncio foi feito nesta quarta-feira, 4, pela organização que concede o prêmio, o Instituto Karolinska, na Suécia. De acordo com o comitê do Nobel, os três cientistas foram premiados “por desenvolver a microscopia crioeletrônica para a determinação de alta resolução das estruturas de biomoléculas em soluções”. O novo método envolve o congelamento extremamente rápido das biomoléculas para que seja possível observá-las em sua forma natural. As aplicações são numerosas, especialmente na área médica.
++ Nobel da Física vai para ondas gravitacionais
Segundo o comitê, graças ao trabalho dos três laureados, logo será possível obter imagens dos complexos mecanismos da vida em resolução atômica – isto é, com imagens que mostram objetos na escala de átomos. “A microscopia crio-eletrônica, que simplifica e aprimora a obtenção de imagens de biomoléculas. Esse método levou a bioquímica para uma nova era”, disse o comitê.
Olhar penetrante
A microscopia crioeletrônica é uma técnica que permite a visualização tridimensional de biomoléculas em alta resolução
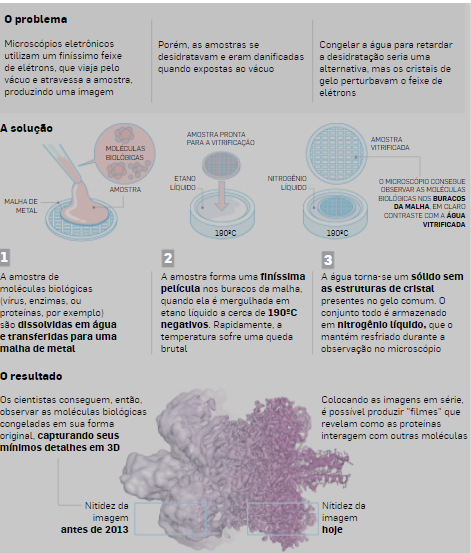
De acordo com a Academia de Ciências da Suécia, os avanços científicos frequentemente se fundamentam na visualização de objetos invisíveis ao olho humano, mas os mapas bioquímicos por muito tempo se mantiveram cheios de lacunas, porque a tecnologia disponível tinha dificuldade em gerar imagens da maior parte da minúscula maquinaria envolvida nos organismos vivos.
+++ Nobel de Medicina vai para descobertas sobre relógio biológico
“A microscopia crio-eletrônica muda tudo isso. Os cientistas agora podem congelar biomoléculas em pleno movimento e visualizar processos que nunca puderam ser vistos antes – isso é decisivo tanto para a compreensão básica da química da vida, como para o desenvolvimento de novos medicamentos”, diz o comitê do Nobel, justificando a premiação dos três cientistas.
Curiosamente, nenhum dos três é químico de formação, mas todos construíram suas carreiras com trabalhos ligados ao aperfeiçoamento da microscopia eletrônica, enveredando pela bioquímica. Dubochet estudou engenharia e, em 1968, tornou-se biólogo. Frank e Henderson se formaram em física.
Ao ser informado sobre a láurea por um telefonema do comitê do Nobel, na manhã desta quarta-feira, Frank se disse surpreso com a premiação. “Fiquei estarrecido. Pensei que as chances de ganhar um prêmio Nobel eram minúsculas”, disse o cientista.
Frank afirmou que a microscopia crioeletrônica é “uma benção” para a pesquisa médica, que está cada vez mais focada nos processos internos das células, mas que ainda será preciso esperar para que a técnica alcance todo seu potencial.
“As aplicações práticas são imensas, mas é preciso sempre esperar um longo tempo para que os resultados da pesquisa fundamental entrem de fato para o conhecimento geral e para a prática da medicina”, afirmou Frank.

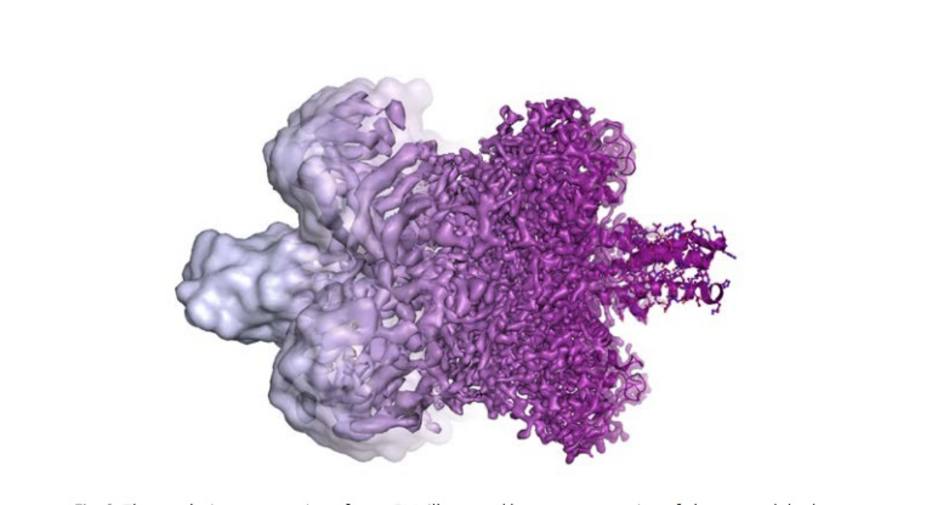
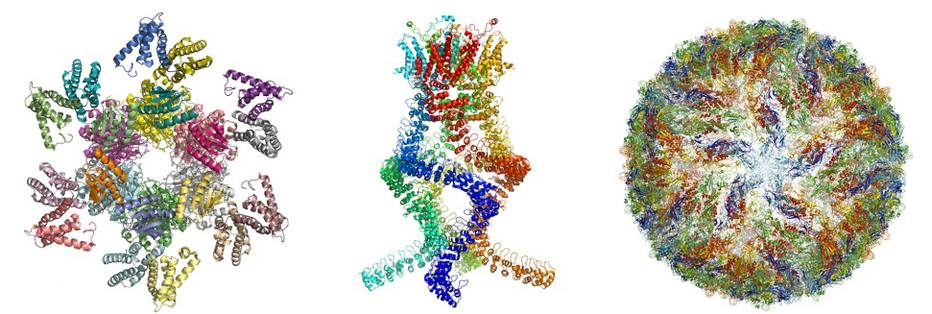
Nos últimos anos, a microscopia crioeletrônica produziu imagens de estruturas moleculares que permitiram diversos avanços. Há centenas de exemplos. Quando os cientistas começaram a suspeitar de que o vírus da zika causava uma epidemia de microcefalia no Brasil, eles utilizaram a técnica para visualizar o vírus. Em poucos meses, foi possível obter imagens tridimensionais do vírus, em resolução atômica e, a partir daí, os pesquisadores puderam começar a buscar potenciais alvos para medicamentos e terapias.
Graças ao método, também foi possível revelar a espécie de “agulha” que a bactéria Salmonella utiliza para atacar as células e descrever em detalhes as proteínas que conferem resistência à quimioterapia e aos antibióticos. Foi possível também estudar as reações que produzem a fotossíntese nas plantas e esmiuçar os sensores de pressão do ouvido humano, que permitem a audição.
A microscopia crioeletrônica também permitiu que os cientistas revelassem os complexos moleculares que regulam os ritmos circadianos – o “relógio biológico interno” dos seres vivos -, um avanço no conhecimento que também rendeu a três cientistas, na segunda-feira, 2, o Prêmio Nobel de Fisiologia ou Medicina.
Presevar para observar
Por muito tempo acreditou-se que os microscópios eletrônicos só serviam para fazer imagens de matéria inerte, porque os seus poderosos feixes de elétrons destroem o material biológico. Mas, em 1990, Richard Henderson conseguiu utilizar um microscópio eletrônico para gerar uma imagem tridimensional de uma proteína em resolução atômica. Esse avanço provou o potencial da nova tecnologia.

Joachim Frank tornou a tecnologia aplicável de forma geral. Entre 1975 e 1986, ele desenvolveu um método de processamento de imagens no qual as imagens borradas de um microscópio eletrônico são analisadas e mescladas para revelar uma estrutura tridimensional clara e bem definida.
Jacques Dubochet adicionou água à microscopia eletrônica. A água líquida evapora no vácuo dos microscópios eletrônicos, o que leva as biomoléculas ao colapso. No início da década de 1980, Dubouchet conseguiu vitrificar a água – ele a esfriou tão rapidamente que ela se solidificou em torno de uma amostra biológica sem formar os cristais de gelo que perturbam o feixe de elétrons do microscópio, permitindo que as biomoléculas mantivessem seu formato natural mesmo no vácuo.

A partir dessas descobertas, cada componente da microscopia eletrônica foi otimizado. A resolução atômica desejada foi alcançada em 2013 e os cientistas agora podem produzir rotineiramente estruturas tridimensionais de biomoléculas.
Nos últimos anos, a literatura científica foi inundada por imagens de todo tipo de biomolécula, desde as proteínas que causam resistência a antibióticos até o mapeamento da superfície do vírus da zika. “A bioquímica encara agora um desenvolvimento explosivo e tudo está pronto para um futuro emocionante”, disse o comitê do Nobel.
Nascido em 1942, em Aigle, na Suíça, Jacques Dubochet atua na Universidade de Lausanne, em seu país natal. Joachim Frank nasceu em 1940, em Siegen, na Alemanha, e trabalha na Universidade Columbia, em Nova York (Estados Unidos). Richard Henderson nasceu em Edimburgh, na Escócia, em 1945 e é ligado ao Laboratório de Biologia Molecular MRC, em Cambridge, no Reino Unido.
O Instituto Karolinska anunciou em setembro um reajuste de 12% no valor dos prêmios Nobel, que permanecia o mesmo desde 2012: 8 milhões de coroas suecas, o equivalente a cerca de US$ 981 mil, ou R$ 3,1 milhões. Os vencedores de 2017 receberão 9 milhões de coroas, o que significa US$ 1,1 milhão, ou cerca de R$ 3,5 milhões. Cada um dos laureados ficará com um terço do Prêmio Nobel de Química.
Revolução bioquímica. “A premiação foi merecida. Essa tecnologia está trazendo uma revolução ao campo que chamamos de biologia estrutural, ou seja, o estudo da estrutura das moléculas que compõem um sistema biolólgico”, disse Glaucius Oliva, professor do Instituto de Física de São Carlos (IFSC), da Universidade de São Paulo (USP).
Há 35 anos, Oliva trabalha com biologia molecular estrutural aplicada ao desenvolvimento de novos medicamentos. Segundo ele, a técnica que utilizou em toda sua carreira – a cristalografia de proteínas – já tinha produzido um grande salto no conhecimento sobre as biomoléculas.
“A cristalografia até hoje é atecnologia dominante e graças a ela que hoje se conhece mais de 130 mil proteínas. Mas a técnica exige uma grande quantidade de proteínas, que precisam estar enoveladas em sua estrutura natural, depois é preciso cirstalizar a molécula e há vários passos até que se possa observá-la. A vantagem da microscopia crioeletrônica é permitir que estudemos moléculas que não precisamos cristalizar – mesmo grandes complexos proteicos”, explicou.
Segundo Oliva, os avanços na microscopia crioeletrônica ainda irão mais longe. “Nos próximos anos, poderemos observar componentes internos das células – e poderemos ver, por exemplo, como um vírus age na célula viva. Isso trará uma nova revolução. Além disso, com essas técnicas é possível observar, em uma mesma amostra, várias conformações possíveis de uma determinada proteína. Assim, com um só experimento, poderemos descobrir várias composições e entender mais sobre a dinâmica e as interações das biomoléculas.”
Outros prêmios
Em 2016, o Prêmio Nobel de Química foi concedido aos pesquisadores Jean-Pierre Sauvage, da França, Sir James Fraser Stoddart, da Escócia e Bernard Feringa, da Holanda, por seus trabalhos no design e síntese de máquinas moleculares.

Entre 1901 e 2017 foram concedidos 109 Prêmios Nobel de Química a 178 cientistas. Frederick Sanger foi o único a ganhar o prêmio duas vezes, em 1958 e em 1980. Assim, 177 pesquisadores na área de química já receberam a láurea.
O prêmio de Química é o terceiro da temporada do Nobel 2017. Na segunda-feira, 2, o Prêmio Nobel de Fisiologia ou Medicina de 2017 foi concedido aos americanos Jeffrey Hall, Michael Rosbash e Michael Young, por suas descobertas sobre os mecanismos moleculares que controlam os chamados ritmos circadianos – uma espécie de relógio biológico interno que regula o metabolismo dos seres vivos.
Na terça-feira, 3, o Prêmio Nobel da Física foi concedido ao alemão naturalizado americano Rainer Weiss e aos americanos Barry Barish e Kip Thorne por sua atuação no Observatório de Ondas Gravitacionais por Interferometria a Laser (Ligo, na sigla em inglês), nos Estados Unidos, que permitiu a detecção de ondas gravitacionais pela primeira vez na história.
O Prêmio Nobel da Literatura terá seu vencedor anunciado na quinta-feira, 5, o prêmio Nobel da Paz será anunciado na sexta-feira, 6 e o das Ciências Econômicas na segunda-feira, 9.
Fonte: Estadão

Agradecemos a leitura, compartilhe!